Investigador de la Universidad Nacional Autónoma de México, estudia las bases neurobiológicas de la toma de decisiones

SENC
El investigador mexicano Ranulfo Romo fue uno de los ponentes del XV Congreso de la Sociedad Española de Neurociencia celebrado recientemente en Oviedo
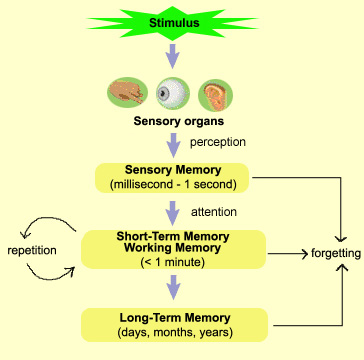
Ranulfo Romo estuvo en España con motivo del XV Congreso de la Sociedad Española de Neurociencias, celebrado en Oviedo del 25 al 27 de septiembre. Investigador del Instituto de Fisiología Celular de l Universidad Autónoma de México (UNAM) y miembro del Colegio Nacional de Mexico, su trabajo se centra en comprender qué hay detrás de la toma de una decisión. “Probablemente tomar una decisión es el mecanismo cumbre de nuestro cerebro. Y dado que no tenemos acceso directo a los procesos finos de la maquinaria cerebral, tenemos que generar modelos experimentales, en mi caso utilizando primates, que en la escala sensorial, motora y de memoria a corto plazo tienen un cerebro muy parecido al nuestro. En monos entrenados para tomar decisiones, como evaluar opciones o información sensorial, podemos estudiar directamente las neuronas involucradas en esta función. Lo bonito de esto es que detrás de una decisión perceptual podemos estudiar mecanismos muy básicos aún no bien conocidos, como por ejemplo cómo se representa la información del mundo externo en nuestro cerebro. Por ejemplo, cuando vemos una cara, ¿se ve en el cerebro?, o ¿qué representación hay en el cerebro auditivo cuando oímos una voz? Y lo que hemos visto es que hay una copia cerebral, neuronal, muy dinámica, de lo que ocurre en el mundo externo. El mundo que percibimos tiene una representación física en la actividad de nuestras neuronas.
-¿Cómo es esa representación?
-La coordinación de chispas eléctricas, que es el lenguaje de las neuronas, en un instante del tiempo representan variables físicas de los estímulos. Se puede decir que las secuencias temporales de una palabra se representan en las chispas eléctricas de las neuronas, es una especie de código digital para reconstruir las imágenes del mundo externo. Esas representaciones son muy útiles porque nos permiten sentir y, como material primario, generar los procesos de percepción. Por ejemplo, en el caso del reconocimiento de una cara, se combina lo que guardamos en la memoria y la representación sensorial inmediata, que se produce en ese momento. Al cotejarlo se reconoce a la persona. Si falla la memoria no sabemos quién es, y si falla la representación sensorial tampoco, como ocurre en Alzheimer, donde se han perdido los circuitos cerebrales de la memoria. Se pueden representar los atributos físicos pero no se pueden combinar con los guardados en la memoria y no lo reconoceríamos, ni podríamos entender las palabras que escuchamos. Hace falta la información sensorial inmediata más la representación del código para decodificar las palabras. Esto nos permite estudiar en qué parte del cerebro y en qué forma guardamos la información y podemos encontrar el código neural de la memoria. Y ver cómo se combina con la entrada sensorial. Y la parte cumbre de todo esto es la toma de una decisión: ahí está esta persona que conozco.
-Según esto, todo lo que hacemos a diario son decisiones…
Absolutamente todo. Y, por ejemplo, cuando tecleamos en el ordenador, el cerebro está tomando decisiones muy rápidas para escribir lo más relevante.
-¿Cómo sabe una neurona lo que es más importante? ¿Tomamos nosotros esa decisión o es una ilusión y en realidad la toman nuestras neuronas?
–Es una ilusión creer que somos dueños de nosotros mismosy que tenemos control en la toma de decisiones. Quienes toman las decisiones son los circuitos neuronales, que en su trabajo por detrás del nivel de consciencia hacen estas operaciones y finalmente mandan una decisión para que creamos que la hemos tomado nosotros. Es cierto que parece que hay un tiempo muy corto, donde interviene la consciencia, y se puede vetar esa decisión. Pero es muy corto, y ahí intervienen mucho los sistemas de educación familiar, que nos hacen ser prudentes. Porque tomar una decisión tiene muchas consecuencias para bien o mal. Y detrás están todos los valores, y tenemos circuitos que le dan valor al contenido de una decisión. Hay decisiones fáciles, difíciles y otras imposibles, pero hay que hacer algo siempre. Aunque sea no hacer nada, que ya es una decisión que tomó el cerebro
-¿Qué circuitos están implicados en la toma de decisiones?
-Cuando se trata de evaluar el contenido de la información que entra por nuestros sentidos, por ejemplo un documento que tiene información, entra por la vista, al leerlo, se representa en la corteza visual y luego viaja por muchos circuitos cerebrales hasta ir a cotejarse con su experiencia, con la información adquirida a lo largo de la vida para tomar una decisión. Hay múltiples circuitos de neuronas que se coordinan espacial y temporalmente para tomar decisiones. Los circuitos muy bien integrados optimizan una decisión. Por ejemplo, los de un ingeniero, un abogado, un médico o un tenista como Rafa Nadal, que basados en la experiencia toman una decisión. Nadal debe tener un circuito muy interesante para coordinar la información visual, auditiva y propiceptiva –[que proporciona información sobre la posición del cuerpo]- y evalúa de dónde llegan las bolas y cómo responder. Estos circuitos tiene que ver con la experiencia previa y el entrenamiento.
-¿Estas habilidades para tomar decisiones son innatas o se pueden entrenar?
-Esa cuestión es un eterno debate. Hay quienes piensan que se nace con circuitos óptimos para ser algo concreto en la vida. Otros tienen la postura de que es una cuestión de educación. Yo pienso que es la combinación de ambas cosas, que hay factores genéticos que optimizan la circuitería cerebral y también que con entrenamiento, es decir, con educación o ejercicio, nosotros podemos hacer circuitos muy óptimos para tomar decisiones. Un cerebro no entrenado, aun con circuitos óptimos, no va muy lejos. Y a la inversa, un cerebro mal construido y bien educado tampoco. Se requiere una combinación de ambas cosas, pero la educación es fundamental.
-¿Las emociones interfieren en la toma de decisiones?
-No solo somos entes racionales. Tenemos también un cerebro emocional. Y así como se combina la información sensorial con la memoria y el aparato motor, también lo hace con el aparato emocional. Las emociones también le dan color a nuestras decisiones. Tiene que ver con los procesos de todos los días, en los que obtenemos recompensas. Cada vez que tomamos una decisión correcta, el cerebro nos da una recompensa. Y tenemos circuitos cerebrales que dan valor a nuestras decisiones. Hace años participé en estos experimentos donde descubrimos que había circuitos cerebrales que tienen una molécula llamada dopamina que da valor al contenido de la información. Sin este valor no podemos aprender ni memorizar, y por tanto sin dopamina la vida podría ser un desastre.
-¿El sistema de recompensa del cerebro está implicado entonces en la toma de decisiones?
-Totalmente. Nuestro cerebro busca recompensas todos los días. Al llegar a casa busca que le reciban bien, que la comida sea sabrosa, que la cama sea la adecuada para un buen descanso, que le llamen sus amigos y le demuestren su afecto. Si hacemos algo mal, como no pasar un examen, la recompensa es tan negativa que puede hacer que nos deprimamos. Este sistema de recompensa da valor a lo que recibimos a cambio de las decisiones que tomamos.
-¿Se puede cambiar esta valoración cambiando nuestra forma de pensar?
-Los psiquiatras, que son más prácticos, le pueden dar una pastilla. Pero cuando se tiene un problema, el hecho de comentarlo con alguien también ayuda. Nuestra vida es importante siempre y cuando uno tenga un impacto en el otro. Solos no somos nadie. Somos alguien por los demás. Yo no sabría si mis decisiones son o no correctas si los demás no me dan una referencia.
-¿La toma de decisiones es exclusiva de nuestra especie?
No. Hasta un gusano como Caenorhabditis elegans tiene que tomar decisiones. Y nos parecemos en que son categóricas. Quizás en lo que nos diferenciamos es que yo puedo posponer mis decisiones y no estoy seguro de que el gusano pueda hacerlo. Las decisiones dependen mucho del medio y del contexto donde esté cada organismo. Aunque son categóricas en ambos casos, las del gusano C. elegans son muy diferentes.
-¿Mucha información perjudica la toma de decisiones?
-No lo creo. Es bueno tener información, pero más importante que eso es tener conocimiento. El paso de información a conocimiento es muy importante. Quizá es algo que aún no se ha evaluado muy bien en nuestras sociedades, porque ahora tenemos acceso a la información, que a veces se confunde con conocimiento. Ese paso significa que damos sentido a la información y que la usamos para un propósito. Cuando leo el periódico tengo acceso a la información. Pero con detalle solo le presto atención a la que es útil para mi vida y la incorpora a mi conocimiento. Y eso requiere una toma de decisiones
-¿Podrán las máquinas tomar decisiones mejor que nosotros en un futuro, un robot, por ejemplo?
-Decisiones razonadas como las nuestras, no creo. Pero hay algo muy importante. Hace unos meses escribí el prólogo de un libro sobre la consciencia y el autor hacía énfasis en si podremos generar alguna vez una consciencia artificial. Una consciencia artificial significa un consciencia capaz de evaluar información, de sentir, percibir y tomar decisiones razonadas y con emociones. El autor sugiere que sí y lo argumenta. Yo dudé, pero me acordé del libro de Verne “Viaje a la luna”. El libro tardó cien años en hacerse realidad. No quiero ser profeta pero quizá en cien años tengamos una consciencia artificial. Y no sé cómo se transformarían nuestras vidas. Crearíamos organismos autónomos con capacidad para tomar decisiones. Y no sé como podrán interaccionar los seres biológicos con esos seres, que después se podrían autoconstruir y generar su propia cultura “artificial”. Yo no lo voy a ver, pero, basándome en lo que ocurrió con Julio Verne, creo que todo lo que uno se imagina algún día lo cristalizará.
-Julio Verne, aunque era abogado, tenía una gran afición por la ciencia y estaba muy al tanto de los avances científicos, de forma que podía intuir que cosas serían factibles en un futuro relativamente cercano y cuáles no. ¿Con el conocimiento que tenemos ahora sobre el cerebro podríamos llegar a crear esa consciencia artificial? ¿O pasará como con la máquina del tiempo imaginada por H.G. Wells, contemporáneo de Verne, que hoy sigue siendo una ficción?
-Por el momento crear una consciencia artificial es prácticamente imposible. Tendríamos que conocer el cerebro muy bien para llegar a eso…y me gustaría que nunca sucediera. Pero dado el avance científico, muy rápido, vamos conociendo los secretos de nuestro propio cerebro. Pero cabe la duda y la posibilidad de que el cerebro mismo, como se estudia a sí mismo, nos genere una trampa, de forma que nunca podamos conocerlo en su totalidad. Y en ese caso generaremos máquinas imperfectas, perfectas sólo para el automatismo, como los ordenadores, que tienen una capacidad de cálculo superior a la nuestra, pero que funcionan sólo con nuestras instrucciones, en forma de programa. Lo que sabemos del cerebro actualmente es mucho y muy poco al mismo tiempo. Sabemos dónde y en qué parte ocurren los procesos cerebrales, pero cómo ocurren, los principios básicos, no solo sabemos.
-¿La teoría del gen egoísta de Richard Dawkins, para explicar las bases biológicas de nuestra conducta, podría interpretarse como “la neurona egoísta”, que toma decisiones por nosotros y nos hace creer que son nuestras?
-Este asunto de Dawkins lo discutía hace poco con mi esposa. Con mi cerebro consciente he decidido preservar mis genes a través mis nietos. Y ocupo mucho de mi tiempo en seguirles de cerca en su educación, llevarles al colegio, enseñarles cosas útiles. No es que quiera hacerlos a mi imagen y semejanza, sino que quiero contribuir a su educación. Y reflexionando con mi esposa, me di cuenta de que en el fondo lo que «a mí me interesaba», en mi egoísmo, era lo que mis neuronas estaban decidiendo: que teníamos que preservar nuestros genes. Es probable que no seamos otra cosa que títeres de nuestras neuronas. Y que todas nuestras decisiones sean producto de nuestra maquinaria cerebral. Y nuestra consciencia no es más que un producto emergente que es muy difícil de ubicar en un lugar concreto, porque es producto de la actividad de nuestras neuronas.
-Esto que dice pone en tela de juicio el libre albedrío…
– Ese es un tema que me interesa mucho. Hace un año organicé un simposio en el Colegio Nacional de México, con personalidades de diversos ámbitos, para discutir si nuestras acciones están determinadas o si tenemos libre albedrío. La conclusión a la que llegamos fue muy interesante: Los físicos y matemáticos, en su mayoría, dirán que todo está determinado. La mayoría de los biólogos pensamos que hay cierta libertad. Sin embargo, hay un experimento muy bonito de Benjamin Libet, en el que registraba la actividad cerebral de sujetos a los que pedía que hicieran un movimiento cuando quisieran, y mientras Libet registraba la actividad cerebral. Y encontró que antes de que los sujetos decidieran mover el dedo, sse activaban sus neuronas. Y al ver este resultado les preguntó cuándo notaron que querían hacer ese movimiento. Y encuentra que 300 milisegundos antes [de la intención] las neuronas estaban activadas, y llega a la conclusión de que todo movimiento voluntario es involuntariamente iniciado y que todo acto conscientemente iniciado es inconscientemente iniciado. Si esto fuera cierto, quiere decir que no tenemos libre albedrío. Sin embargo, existe la posibilidad de que tengamos una franja de tiempo muy corto donde podemos juzgar ese deseo, esa intencionalidad y dejarla pasar, bloquearla, vetarla o modularla. Puede que los asesinos tengan mucho más corto este tiempo y no puedan cancelar la ejecución de la acción. Si existe el libre albedrío, tendríamos una franja de tiempo muy corta para modular nuestras acciones y decisiones.
– Entonces, la frase de Cajal, padre de la neurociencia moderna, que dice que un hombre puede, si se lo propone, esculpir su propio cerebro, ¿cómo encaja?
-Por supuesto, porque en el fondo, una vez que he tomado una decisión recibo un feedback externo que va moldeando mis acciones. De hecho, se dice que sólo se aprende de los errores, y no de los refuerzos positivos, o éxitos. Si Nadal no se entrenara, por más aptitudes que tenga, no sería el campeón que es ahora. Si don Santiago Ramón y Cajal no hubiese pasado horas y horas al microscopio viendo las muestras de tejido que preparaba, nunca hubiese podido ser el gran neurobiólogo español, quizá el más grande todos. Y se hizo a sí mismo, con muy pocos recursos. Cuando tomamos un libro para leerlo, por ejemplo, supone una opción personal, una disciplina para sentarse y leerlo. Toda acción tiene un coste, con un refuerzo positivo o negativo. Y de esas dos cosas muy elementales, binarias, uno va esculpiendo su cerebro haciéndose a si mismo lo que uno cree que quiere ser.
-Pertenece a Colegio Nacional de México, ¿qué significa eso para usted?
-Somos un grupo de 40 personas de diversos ámbitos: pintores, novelistas, matemáticos… Diego Rivera perteneció a la Sociedad, así como Mario Molina (Nóbel de Química en 1995) Octavio Paz o Carlos Fuentes, recientemente fallecido, un grupo selecto de personas. Esto nos otorga una posición vitalicia muy conveniente para los miembros, porque tenemos mucha libertad para nuestro trabajo. El lema es ‘libertad por el saber’. No dependemos de las instituciones, sino de nosotros mismos. Somos libres.
–Eso, si las neuronas se lo permiten….
-Exactamente…
Ranulfo Romo: «Es probable que no seamos otra cosa que títeres de nuestras neuronas» – ABC.es.